研究紹介
- 研究紹介
- 炎症性腸疾患と糖鎖
炎症性腸疾患と糖鎖
炎症性腸疾患(Inflammatory Bowel Disease; IBD)は、クローン病と潰瘍性大腸炎に大別される難治性疾患で、厚生労働省の特定疾患にも指定されています。いずれも10歳代から30歳代の青年期に多く発症し、発熱や下痢、腹痛、血便などを伴い、生活の質(QOL) を著しく低下させることから、社会的損失も大きい疾患です。また長期経過で発癌のリスクも高まると報告されています。遺伝的背景や食餌抗原、環境因子など、多種の要因が疾患に関連しているといわれていますが、いまだ原因は不明の難病です。我々は、この炎症性腸疾患の原因究明や、診断・治療法の向上を目指して研究を行っています。特に「患者さんから学ぶ」研究に力を入れており、患者さんの臨床データや検体を用いて、糖鎖研究の観点から、免疫学的、生化学・分子生物学的アプローチから病態に迫ろうと努めています。
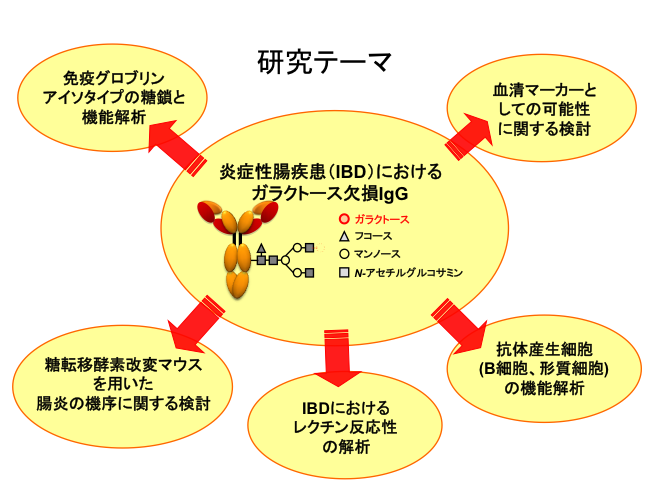
主な研究内容
- IBDにおけるガラクトース欠損IgGに関する検討:血清中のIgGは液性免疫の主役ですが、近年その糖鎖がIgGの機能に直接関与することが証明され、脚光を浴びています。IBD患者においてフコシル化糖鎖のガラクトースが欠損する(Am J Gastroenterol. 2008)ことから、その臨床的意義の究明を行うとともに、血清マーカーとしての可能性についても研究しています。
- IBDにおけるB細胞の機能解析:IBDにおいてIgG糖鎖が変化するメカニズムについて、抗体産生細胞であるB細胞を中心とした機能解析を行っています。
- 糖鎖と腸炎との関連についての検討:糖鎖はヒトの細胞だけでなく、腸内細菌にも存在し重要な役割を果たしています。糖鎖の変化が、腸炎にどのような影響をもたらすのかの検討を行っています
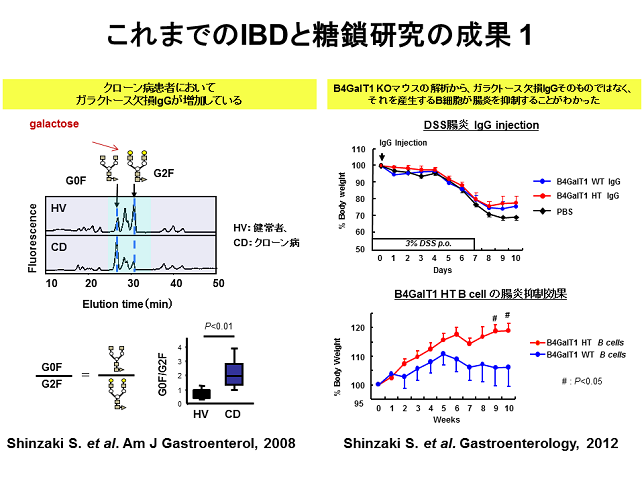
これまでの研究成果1
ガラクトース欠損IgGの評価として私達はG0F/G2Fという指標を定めました。G0F/G2F値は、クローン病で有意に高く、臨床的な病態をよく反映しました。また潰瘍性大腸炎の再発予測やレミケードに対する治療効果判定にも有用です。しかし、HPLCを用いた従来法では、1検体あたりの測定時間がかかるため多検体処理には向いていません。そこでレクチンー抗体ELISA法を開発し、現在のところ精製したIgGとABA&GSL-IIという2種類のレクチンの組み合わせで、ガラクトース欠損IgGを定量できることがわかりました(IBD journal 2013)。また、ガラクトース転移酵素ノックアウトマウスを使った研究から、ガラクトース欠損IgGがIBDで増加する機序としては、病態の進展を抑制させる免疫反応ではないかということがわかりました(Gastroenterology 2012)。すなわち、B細胞とマクロファージの相互作用を糖鎖とガレクチンというものが調節し、ガラクトース欠損によって抑制性のサイトカインIL10を分泌しやすくするという結果です。現在、その詳細な分子機序を解析中です。
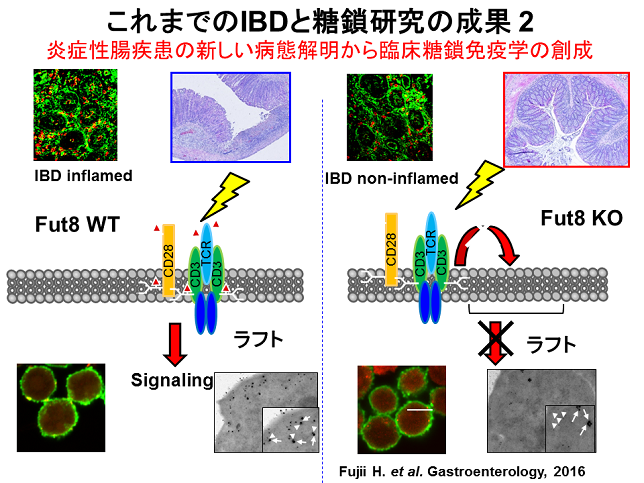
これまでの研究成果2
我々はコアフコシル化という最近糖鎖修飾がT細胞のシグナル伝達に極めて重要な役割を担っていることを見いだしました(Gastroentelorogy 2016)。Fut8はコアフコシル化を担う唯一の糖転移酵素です。Fut8は炎症性腸疾患においてヒト、マウスで炎症部位に発現が亢進することがわかりました。我々はFut8欠損マウスでは炎症性腸疾患モデルであるTNBS腸炎が起こりにくいことを発見しました。炎症性腸疾患においてT細胞は極めて重要な役割を担っています。T細胞での炎症反応にはT細胞受容体によるシグナル伝達が必須です。炎症時、T細胞受容体は細胞膜のラフトと呼ばれる場に移動してそのシグナルを伝達します。Fut8欠損T細胞ではコアフコースの欠損によりT細胞受容体がラフトに移動することができなくなることを我々は見いだしました。炎症性腸疾患は難治性の疾患ですがコアフコシル化の制御により炎症を制御できる可能性を世界で初めて示すことができました。今後コアフコシル化の制御を標的とした炎症性腸疾患の新たな治療法開発に繋げていきたいと考えています。