研究紹介
- 研究紹介
- 新しい糖鎖がんマーカーの開発
新しい糖鎖がんマーカーの開発
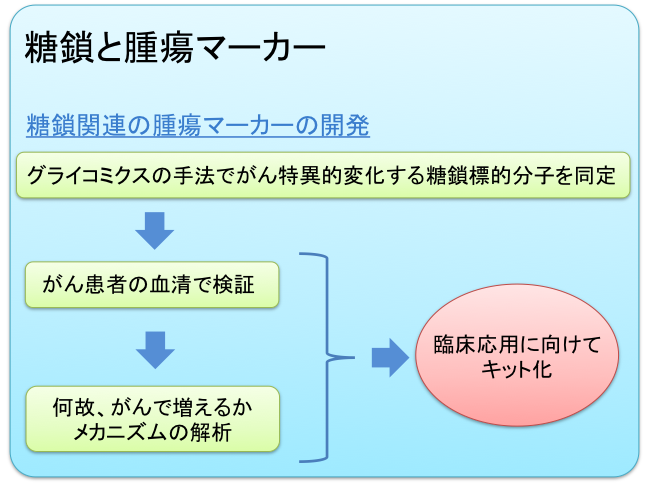
今日、臨床の場で用いられている腫瘍マーカーの多くが、がんに伴い出現する異常糖鎖を認識する抗体です。糖鎖の末端やその他の部分にフコースという糖の一種が結合することをフコシル化といいます。がん化に伴う糖鎖構造の異常の中で、このフコシル化の増加・減少は最も重要な変化の一つです。こうした異常糖鎖を網羅的に同定し、機能解析する手法をグライコミクスと呼びます。私達の研究室では、このグライコミクスの手法を使って、糖鎖関連の腫瘍マーカーを同定し、その産生メカニズム解析とともに臨床応用を目指したキット化に取り組んでいます。以下にその実例を1つ示します。
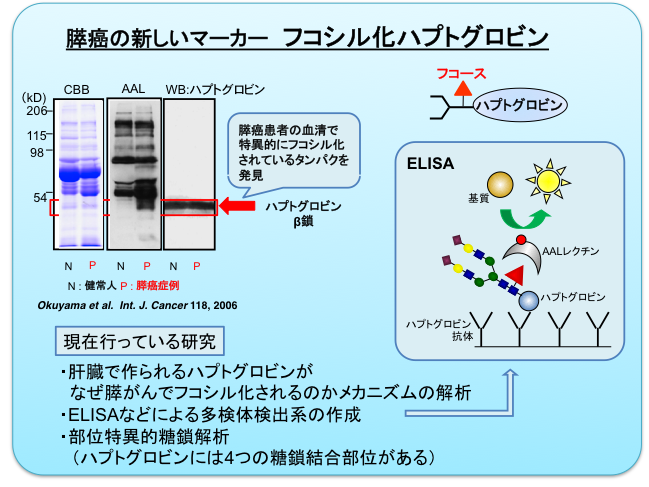
膵がんは早期診断に有用な腫瘍マーカーが存在せず、極めて予後不良の難治性のがんであると言われています。現在膵がんの腫瘍マーカーとしてはCA19-9が用いられていますが、初期がんでの陽性率は低く、新しい腫瘍マーカーの開発が必要とされています。当研究室では、膵がんの新しいマーカーとしてフコシル化ハプトグロビンを発見しました(Miyoshi E, & Nakano M. Proteomics 8(16), 3257-3262、2008. review)。ハプトグロビンは、本来炎症時に上昇する急性期タンパクの1つで、主に肝臓で産生されます。このハプトグロビンの糖鎖にフコースが付加されたものをフコシル化ハプトグロビンと呼び、がん患者の血清で増加します。現在、その産生機構や部位特異的な糖鎖解析(ハプトグロビンには4つの糖鎖結合部位があります)に関する研究を行っています。このフコシル化ハプトグロビンを多検体処理できる定量法を作るため、さらに臨床応用に向けてlectin-ELISA(enzyme-linked immunosorbent assay)系の確立を目指してきました。
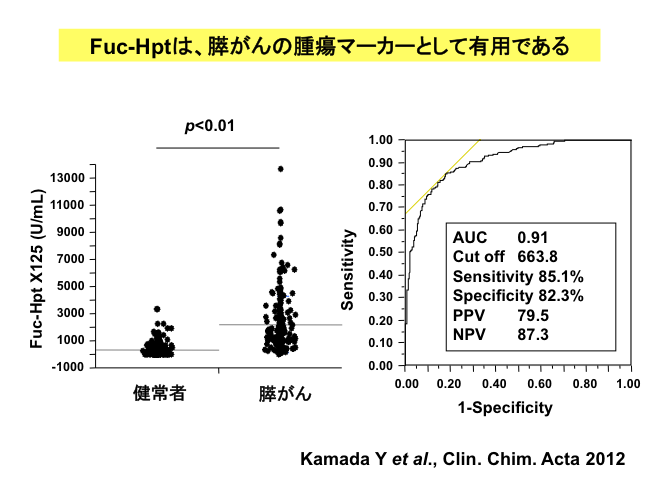
一昨年、タカラバイオ研究所、免疫生物研究所との共同研究により、このフコシル化ハプトグロビンのlectin-ELISAキットの開発に成功しました(Kamada Y et al, CCA, 2012)。様々ながんで検討したところ、膵がんだけでなく大腸がんでも40-50%の陽性率を示し、特に肝転移がある症例では陽性を示すようです。従って、大腸がんの術後予後との関係を調べると、フコシル化ハプトグロビンとCEAが共に陽性症例では、陰性例に較べて予後不良であることがわかりました(Takeda Y et al. Cancer 118(2), 2011)。フコシル化ハプトグロビンの産生には、フコシル化AFPと同じく肝細胞の極性が関与するのかもしれません。今後は、がんだけでなく他の良性疾患に対しても、このフコシル化ハプトグロビンELISAキットの有用性を検討していく予定です。また、他にも疾患マーカーとなりうる糖タンパク質を、グライコミクスの手法により、いくつか同定していますので、それらのキット作成とともに臨床応用を考えています。