研究紹介
- 研究紹介
- フコシル化制御の分子機構
フコシル化制御の分子機構
フコースは糖鎖を構成する単糖の一つであります。フコシル化糖鎖には様々な生理活性がありますが、がん・炎症と最も関係が深い糖鎖修飾の1つです。シアリルルイス型糖鎖を介したがんの血行性転移に関与したり、肝がんに対してのAFP-L3分画を代表とした様々な腫瘍マーカーとして臨床応用されています(図1)。
では、フコースを付加する反応(フコシル化)はどこでどのようにして起こっているのでしょうか(図2)?そもそも糖鎖の生合成は小胞体から始まり、ゴルジ体を通過する過程において成熟していきますが、フコシル化はゴルジ体で起こります。そこでフコース転移酵素がドナー基質であるGDP-フコースを利用してフコースを転移します。我々の研究により、様々な生体反応や疾患でみられるフコシル化の変化には、フコース転移酵素の発現の変化だけでなく、GDP-フコースの量的変化も重要であることが分かっています。GDP-フコースは元々細胞質で合成されます。合成経路にはサルベージ経路とde novo経路がありますが、細胞内GDP-フコースの殆ど全てを供給しているのはde novo経路であります。de novo経路では、GMDS、FXといったGDP-フコース合成酵素によりGDP-マンノースからGDP-フコースを合成します。合成されたGDP-フコースはゴルジ体膜上に存在するGDP-フコーストランスポーターによりゴルジ体内腔へ輸送され、糖転移反応に利用されます。フコシル化はこのように様々な分子が関与する非常に複雑な機構によって制御されています。我々はこのフコシル化の制御機構を詳細に解析し、生体でみられるフコシル化の変化がどのようにして起こっているのか、そしてそのフコシル化が生体にとってどのような意味を持っているのかを明らかにすることを目的として研究を進めています。
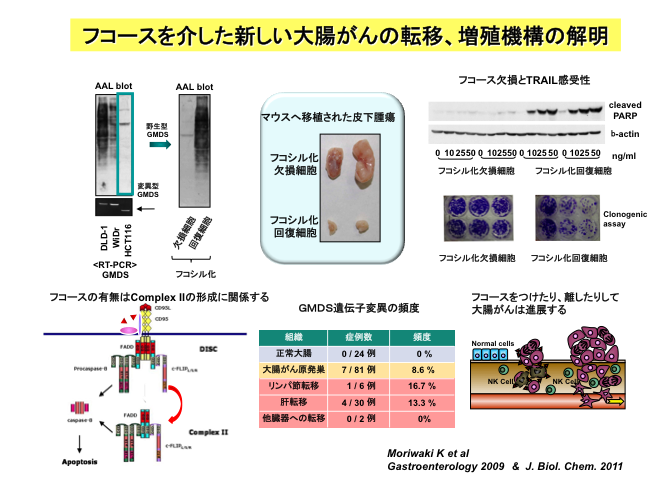
一般的に、がんではフコシル化が増加すると考えられてきました。しかし、HCT116という大腸がん細胞では、GDP-フコースのde novo経路の律速酵素GMDSの欠損によりフコシル化が完全欠損します。TRAILやFas-ligandというサイトカイン処理に対して、フコースが欠損するとその作用が抑制されます。では、なぜフコース欠損によって、これらのサイトカインのシグナルが伝達されないか、それは現在のところまだわからない難問です。恐らく膜表面の複数の糖タンパク質が複合体を形成し、細胞内に取り込まれるときにフコースが重要だと考えています(図3)。また、このGMDSの変異は、ヒト大腸がん組織においても認められたため、実際のヒトの大腸がんの発がん過程で広く見られる現象なのかもしれません。いずれにしましても、この糖鎖シグナルとも呼べる一連の現象は、今日の糖鎖生物学研究で非常にホットな話題です。
図1
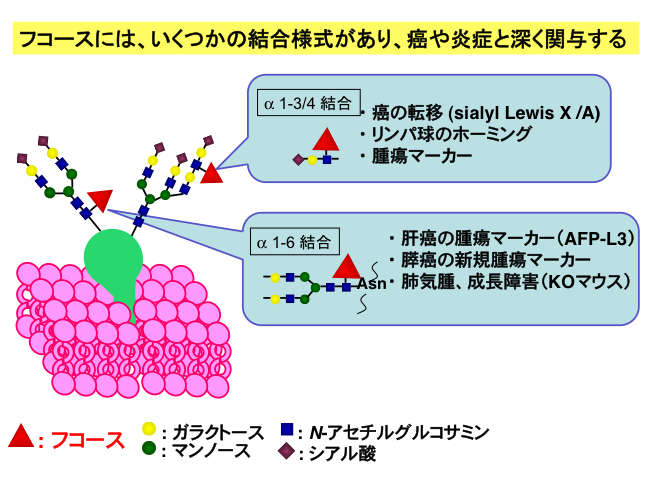
図2
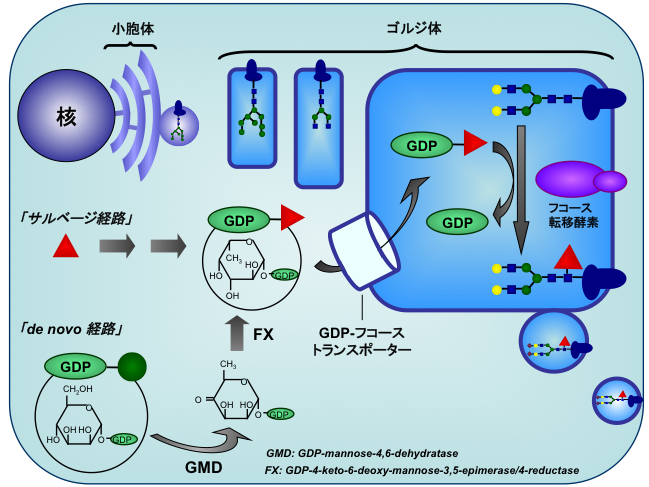
図3