研究紹介
- 研究紹介
- 細胞の極性輸送介
糖タンパク質の極性輸送と腫瘍マーカーの産生機構
フコシル化α-フェトプロテイン(AFP-L3)は肝がん患者の血清に特異的に検出される有用な腫瘍マーカーとして広く用いられています。つまり肝硬変を代表する良性の慢性肝疾患では、AFPそのものは上昇してもAFP-L3の血中レベルは非常に低いわけです。私達は、肝がん患者の血清特異的に増加するメカニズムに関して、長年研究してきました。まず、AFP-L3の合成に関与する糖転移酵素であるα1-6フコース転移酵素(Fut8)の分離精製と遺伝子クローニングを行いました(Uozumi et al, JBC, 1996)。しかしFut8の遺伝子発現は肝がんだけでなく、周囲の肝硬変組織でも増加します。次にFut8のドナー基質であるGDP-フコース量の定量系を確立し、AFP-L3の産生にGDP-フコースが重要であることを明らかにしました(Noda et al, Cancer Res, 2003)。しかし、GDP-フコース量の増加は、肝がんで肝硬変の2倍程度しか見られず、AFP-L3の合成の増加のみでは肝癌患者の血清特異的に検出されるメカニズムを説明できないと考えられます。
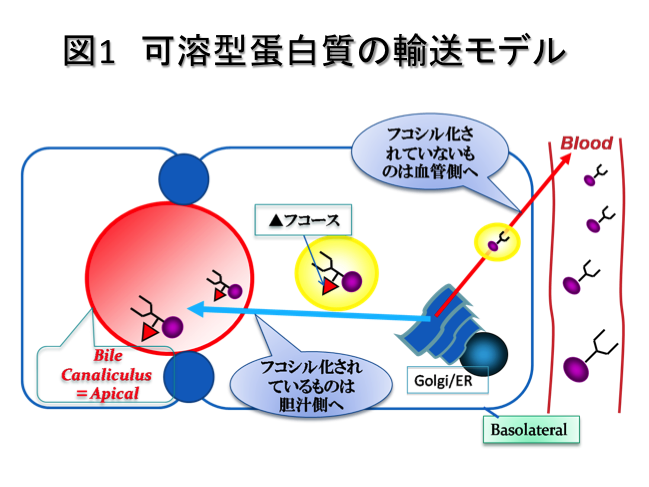
そこで新たな仮説として、肝細胞の癌化による極性輸送機構の変化がAFP-L3の産生メカニズムに関与していると考えました。これまでの結果から、胆汁中の糖蛋白質の糖鎖は血清中の糖蛋白質の糖鎖に比べてフコシル化されていること、フコシル化糖鎖を合成できないFut8ノックアウトマウスの胆汁中の糖蛋白質レベルは野生型マウスに比べて著しく減少していることが明らかとなり、フコシル化糖鎖が胆汁中への分泌シグナルとなっていることが示唆されました(Nakagawa et al, JBC 2006)。図1では、肝細胞において、AFP-L3などの可溶型蛋白質がどのように輸送されるかというモデルを示しています。図1で見られるようなフコシル化糖鎖を分泌シグナルとした選別輸送機構の破綻によって、肝癌患者の血清特異的にAFP-L3が増加すると考えています。(図2)
そこで我々は、AFP-L3の産生・分泌機構を明らかにし、フコシル化と極性輸送という概念に基づいた新たな糖鎖関連腫瘍マーカーの発見につなげるため、肝臓におけるフコシル化糖タンパク質の極性輸送機構について研究を行っています。この極性輸送機構に関しては、AFPのみならず複数の糖タンパクが関与しますが、ある程度の選択性があると考えられます(Nakagawa et al, J. Proteome Res, 2012)。その理由としては、糖鎖構造だけでなく糖鎖のつく位置や、糖タンパク質の構造によって変化するのだと想定しています。また、ある糖タンパク質がフコシル化されることで、どのような生物学的機能が変化するのか、十分わかっていません。一つだけはっきり証明されていることは、IgGのフコース付加の有無でATCC(抗体依存性細胞障害活性)が50-100倍変わることです。また、どうして生体内にフコシル化タンパクを胆汁中に分泌させる機構があるのかという生理学的な意味も不明です。
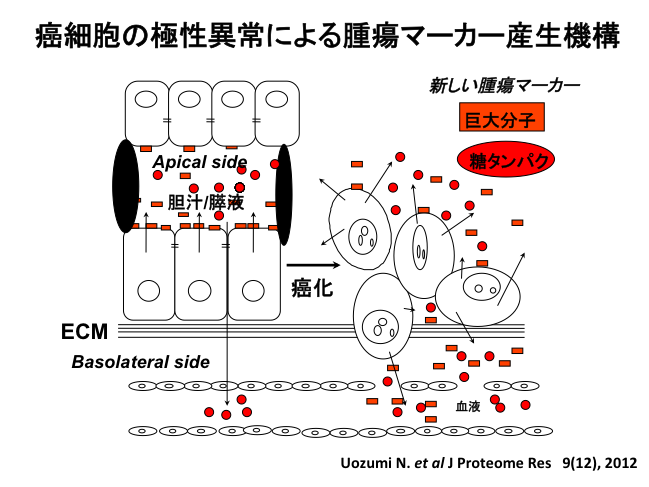
今日、腫瘍マーカーとして広く臨床応用されているCA19-9やCEAは、がん細胞に特異的に産生されるのではなく、がんに伴って細胞の局性が変化し、分泌異常が起こるためと考えられています。即ち、正常細胞ではapical、basolateralに分泌されるタンパク質に一定の法則があるのに対して、がん細胞ではその機構が破綻します。上述のフコシル化タンパクの輸送を考えると、肝細胞の胆管側がapical側、血管側がbasolateralにあたります。最近私達は、膵がんの腫瘍マーカーとして知られるCA19-9の新しいキャリア分子を同定し、その細胞内輸送に関わるCABINという新規のタンパク質を見つけました(Uozumi et al, J Proteome Res, 2012)。CA19-9はシアリルルイスAという糖鎖を認識する抗体で、従来からO型糖鎖を多くもつムチンがCA19-9のキャリア分子と考えられてきました。私達の同定した新しいCA19-9のキャリア分子は、脂質膜複合体です。21世紀の第4世代腫瘍マーカーとして、脂質複合体の定量化を考えています。そして、がん細胞におけるその複合体の生物学的な意味を解析することで、新しい診断技術や治療法の開発を目指しています。
タンパク質の膜輸送の研究は、多くの細胞生物学者にとって非常にホットな研究領域と言えます。膜輸送の主役は、多くのRab familyに属するタンパクです。Rabそのものは糖タンパクではありませんが、もしかしたらどこかで糖鎖やレクチンと関係があるのではという、やや妄想的な可能性を考えています。がん細胞は、つくった料理(糖タンパク)をテーブルに運ぶのが下手です。そのランダムな糖タンパク質の給仕が、腫瘍マーカーの産生につながります。多くの病理学者が、核の大きさと細胞の極性の乱れで、がんの病理診断を行います。細胞の極性の乱れから血中に分泌される糖タンパクの解析は、まさに「がん化を生化学的に見る」という研究なのかもしれません。