研究紹介
- 研究紹介
- 膵がんへの挑戦
膵がんへの挑戦
膵がんは、5年生存率が極めて低い最大の難治がんです。この20年間で、他のがんの予後はかなり改善されてきましたが、膵がんに関しては少し良くなった程度です。その理由として早期発見が非常に困難で、初診時手術可能な症例が半分に満たないのです。たとえ手術しても、かなり多くの症例が1年以内に再発するため、術前の画像診断で捉えきれなかった多くの転移巣の存在が示唆されます。また、肝がん、胃がん、子宮がんのように原因となる基礎疾患が膵がんではわかっていないのも、早期発見が困難な理由の一つです。私達の研究室では、糖鎖科学の力で膵がんに対する新しい診断マーカーと治療法の開発を目指しています。
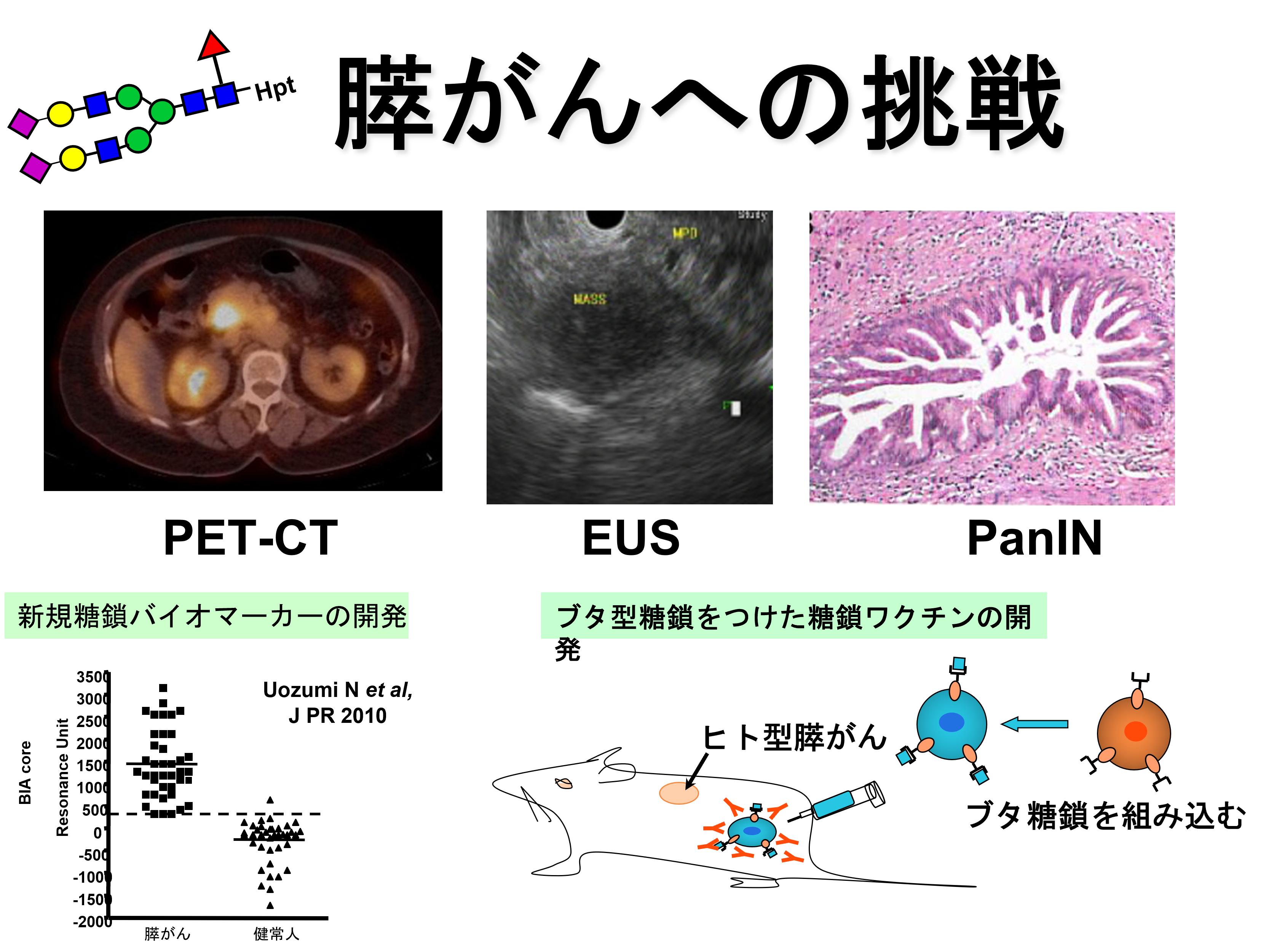
1 膵がんの新しい診断マーカーの開発
現在、臨床の場ではCA19-9という腫瘍マーカーが頻用されています。しかし、CA19-9が上昇したとき、多くの症例が進行がんです。正常値前後のわずかな上昇に早期膵がんが含まれる可能性はありますが、多くの良性疾患や健常者がこの中に含まれてしまいます。腹部エコーで早期膵がんを発見することは難しく、侵襲的なERCPやEUSを全症例に適応することは、かなり抵抗があります。私達の研究室では、フコシル化ハプトグロビンという新しい膵がんの糖鎖マーカーを見つけました (腫瘍マーカーの項目を参照してください)。しかし、このフコシル化ハプトグロビンだけでは、早期の膵がんを見つけることは困難です。実際にフコシル化ハプトグロビンそのものを認識する次世代型糖鎖抗体10-7G mAbを作成したところ、フコシル化ハプトグロビンの産生臓器は、肝臓に転移した膵がん周囲の肝細胞であったのです (Nishino et al, Oncotarget 2018)。また、CA19-9は単一の蛋白を認識しているのではなく、シアリルルイスAという特殊な糖鎖構造をたくさんもつ物質を認識します。従来から、ムチンという糖タンパクがCA19-9のキャリア分子として知られてきましたが、私達は新しいCA19-9のキャリア分子として微小脂質膜複合体を同定しました (Uozumi et al, J Proteome Res. 2010)。詳細は糖タンパク質の極性輸送と腫瘍マーカーの産生機構の項目を参照してください。
2 膵がんに対する糖鎖ワクチン療法の開発
冒頭に書きましたように、膵がんは早期から転移しやすく、臨床病期がStage IやIIであっても、手術後早期に再発します。これは、術前に画像検査で見つからない病巣が肝臓やリンパ節に存在するためと考えられます。このため手術療法だけでなく、がんワクチン療法や抗がん薬/放射線療法との併用が重要と思われます。 ブタ型糖鎖は、異種臓器移植の原因として古くから研究されてきましたが、近年この原理をがん免疫療法に応用しようという試みがなされて来ました(Deguchi T, Tanemura M et al, Cancer Res. 2010; Tanemura M, Miyoshi E et al, World J Gastroenterology, 2015)。私達の研究室では阪大消化器外科(江口英利教授、種村匡弘招へい教授)、阪大理学部(深瀬浩一教授、真鍋良幸助教)との共同研究により、ブタ型糖鎖ワクチンの開発と臨床応用を目指しています。
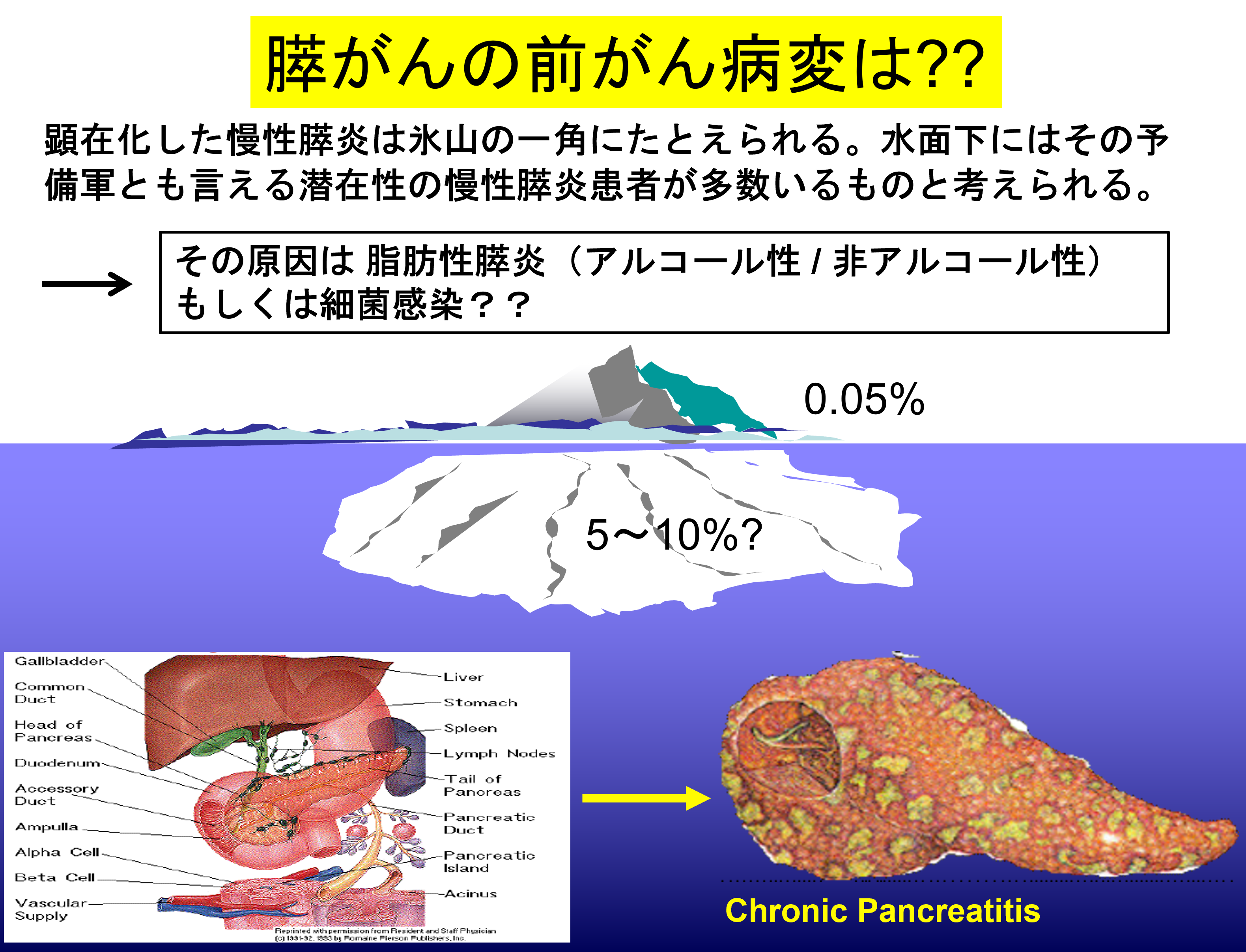
3 膵がん・慢性膵炎の病態進展における細菌感染の関与
膵がん周囲の正常組織には、炎症細胞の浸潤、脂肪変成、線維化など慢性膵炎が存在することを病理学的な解析から発見しました(Tomita Y, Miyoshi E et al, Pancreas 2014)。これらの患者の病歴には、飲酒歴や喫煙歴はあるものの、慢性膵炎という臨床診断が見られませんでした。このため、こうした病理学的にのみ確認できた膵炎は、潜在性慢性膵炎と呼べるかもしれません。また膵頭部がんだけでなく、膵尾部がんでも同様の変化を認めたことから腫瘍による閉塞病変だけとは言えないと思います。さらに、こうした変化は画像診断によっても検出可能であることを見出しました(阪大放射線科 富山憲幸教授との共同研究、Eur. J. Radiol, 2019)。 それでは、潜在性膵炎の原因は、何でしょうか?消化器外科の江口英利教授との共同研究により、膵がん患者の膵液中および膵臓組織内にE. faecalis(フェカリス菌)が存在することを見出しました(Maekawa T and Miyoshi E et al, BBRC 2018)。既報に従い、フェカリス菌の莢膜多糖を固相化したELISA系によって、莢膜多糖に対する抗体測定系を作ったところ、慢性膵炎・膵がん患者の血清中で増加していることがわかりました。本来、腸内共生菌と考えられるフェカリス菌は、非常にアルカリ性に対する耐性が強く、pH8の膵液中でも生存することが可能です。