研究紹介
- 研究紹介
- 糖鎖とがん幹細胞
糖鎖とがん幹細胞
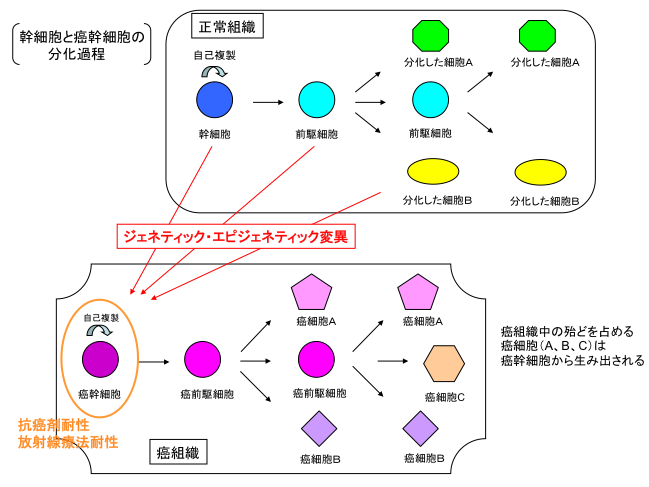
幹細胞とは、「多分化能と自己複製能をもった細胞」であり、組織および器官を構成する様々な細胞を供給するという役割を担っています。ある刺激をうけると特定の細胞へと分化する能力のことを分化能といい、幹細胞は前駆細胞をへて多様な細胞へと分化できる多分化能を持っています。自己複製能とは、自らと全く同じ性質をもった細胞を作り出す能力で、幹細胞は未分化な状態を維持することができます(図1)。このような性質から幹細胞は再生医療のツールとして注目されています。
(図1)
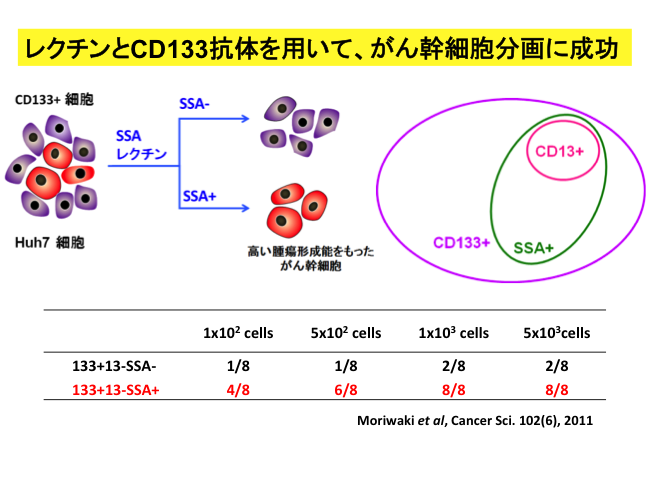
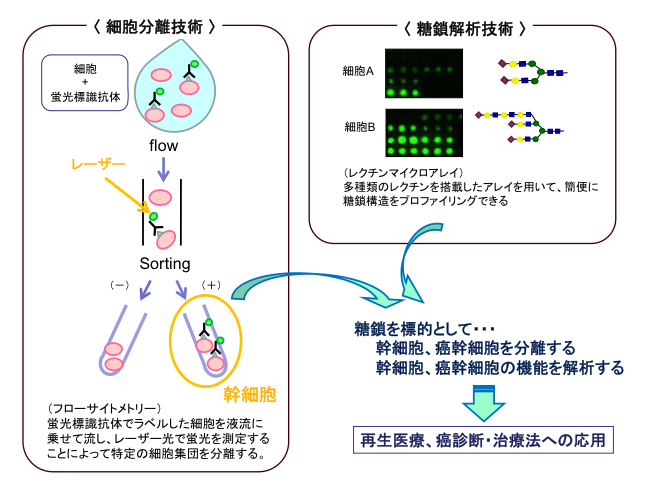
近年、がんを生み出す幹細胞(がん幹細胞)が存在するという考えが注目されています。このがん幹細胞は、強い自己複製能とがん形成能をもっており、がん組織中に存在する大部分のがん細胞は、がん幹細胞が生み出した限定された増殖能力をもつがん前駆細胞や、分裂能力を失ったがん細胞と考えられています。さらに、がん幹細胞は抗がん剤や放射線療法にも耐性を示し、がん再発の原因であるといわれています。そのため、がんの根治的治療法の開発にはがん幹細胞の単離・解析が必要となってきます。一方、糖鎖は細胞表面上に存在する殆ど全ての膜タンパク質を修飾しています。それぞれの細胞は細胞固有の糖鎖構造を持っており、糖鎖は細胞の顔と言われています。そこで、われわれの研究室では様々な糖鎖構造解析技術(レクチンマイクロアレイ)や細胞分離技術(フローサイトメトリー)を用いて幹細胞・がん幹細胞特有の糖鎖構造を見いだし、糖鎖を用いた幹細胞・がん幹細胞の分離方法を確立すること、そしてそれらの詳細な解析を通して再生医療やがん治療に応用していくことを目的として研究を進めています(図2)。私達の研究室では、ヒト肝がん細胞Huh7から、CD133抗体とSSAレクチンを使ってがん幹細胞分画の単離に成功しました(Moriwaki et al, Cancer Sci. 102(6), 2011)。この研究結果は、ある程度肝がん細胞で共通の現象ですが、がん種を変えると標的となる糖鎖が異なるところが不思議です。
(図2)
がん幹細胞の生化学的な解析を行うとき、最大の難関は、細胞数が極めて少なく、十分なタンパク量を得ることができない点です。この問題点を克服するため、多くの研究室では抗がん薬を使って、がん幹細胞を濃縮する手法をとっています。興味深いことに、がん幹細胞の表面マーカーで単離した細胞と抗がん薬耐性細胞が比較的共通の糖鎖構造を示す点です。上述のように、がん幹細胞は治療抵抗性を示すため、それに対する分子標的治療(DDSを含む)の開発が重要と考え、現在その課題にも取り組んでいます。
(図3)